Сьогодні неалкогольна жирова хвороба печінки (НАЖХП) стала основною причиною хронічних захворювань печінки в Китаї та навіть у світі. Спектр захворювань включає простий печінковий стеатогепатит, неалкогольний стеатогепатит (НАСГ) та пов'язані з ним цироз і рак печінки. НАСГ характеризується надмірним накопиченням жиру в гепатоцитах та індукованим пошкодженням клітин і запаленням, з печінковим фіброзом або без нього. Тяжкість фіброзу печінки у пацієнтів з НАСГ тісно пов'язана з поганим прогнозом для печінки (цироз та його ускладнення та гепатоцелюлярна карцинома), серцево-судинними подіями, позапечінковими злоякісними новоутвореннями та смертю з усіх причин. НАСГ може негативно впливати на якість життя пацієнтів; однак, жодні ліки чи методи лікування не були схвалені для лікування НАСГ.
Нещодавнє дослідження (ENLIVEN), опубліковане в New England Journal of Medicine (NEJM), показало, що пегозафермін покращує як фіброз печінки, так і запалення печінки у пацієнтів з нециротичною НАЖХП, підтвердженою біопсією.
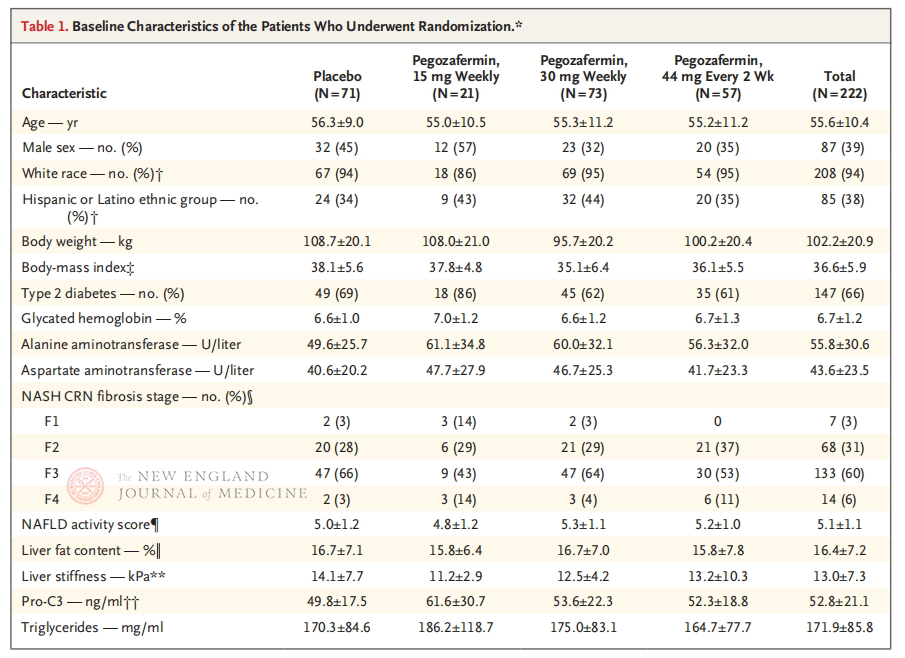
У багатоцентровому, рандомізованому, подвійному сліпому, плацебо-контрольованому клінічному дослідженні фази 2b, проведеному професором Рохітом Лумбою та його клінічною командою в Медичній школі Каліфорнійського університету в Сан-Дієго, взяли участь 222 пацієнти з підтвердженою біопсією НАЖХС стадії F2-3 у період з 28 вересня 2021 року по 15 серпня 2022 року. Їм було випадковим чином призначено пегозафермін (підшкірна ін'єкція, 15 мг або 30 мг один раз на тиждень, або 44 мг один раз на 2 тижні) або плацебо (один раз на тиждень або один раз на 2 тижні). Первинними кінцевими точками були покращення фіброзу ≥ 1 стадії та відсутність прогресування НАЖХС. НАЖХС зникла без фіброзної прогресії. У дослідженні також було проведено оцінку безпеки.
Після 24 тижнів лікування частка пацієнтів з покращенням фіброзу ≥ 1 стадії та без погіршення НАЖХП, а також частка пацієнтів з регресією НАЖХП та без погіршення фіброзу були значно вищими у трьох групах дозування пегозаферміну, ніж у групі плацебо, з більш значними відмінностями у пацієнтів, які отримували 44 мг один раз на два тижні або 30 мг один раз на тиждень. З точки зору безпеки, пегозафермін був подібним до плацебо. Найпоширенішими побічними ефектами, пов'язаними з лікуванням пегозаферміном, були нудота, діарея та еритема в місці ін'єкції. У цьому дослідженні фази 2b попередні результати свідчать про те, що лікування пегозаферміном покращує фіброз печінки.
Пегозафермін, що використовується в цьому дослідженні, є глікольованим аналогом людського фактора росту фібробластів 21 (FGF21) тривалої дії. FGF21 – це ендогенний метаболічний гормон, що секретується печінкою, який відіграє роль у регуляції метаболізму ліпідів та глюкози. Попередні дослідження показали, що FGF21 має терапевтичний вплив на пацієнтів з НАЖХ, підвищуючи чутливість печінки до інсуліну, стимулюючи окислення жирних кислот та пригнічуючи ліпогенез. Однак короткий період напіввиведення природного FGF21 (близько 2 годин) обмежує його використання в клінічному лікуванні НАЖХ. Пегозафермін використовує технологію глікозильованого пегілювання для продовження періоду напіввиведення природного FGF21 та оптимізації його біологічної активності.
Окрім позитивних результатів цього клінічного випробування фази 2b, інше нещодавнє дослідження, опубліковане в Nature Medicine (ENTRIGUE), показало, що пегозафермін також значно знижує рівень тригліцеридів, холестерину, відмінного від ЛПВЩ, аполіпопротеїну B та стеатоз печінки у пацієнтів з тяжкою гіпертригліцеридемією, що може позитивно впливати на зниження ризику серцево-судинних подій у пацієнтів з НАЖХ.
Ці дослідження показують, що пегозафермін, як ендогенний метаболічний гормон, може забезпечити численні метаболічні переваги для пацієнтів з НАЖХП, особливо тому, що НАЖХ може бути перейменовано на метаболічно асоційовану жирову хворобу печінки в майбутньому. Ці результати роблять його дуже важливим потенційним препаратом для лікування НАЖХП. Водночас, ці позитивні результати дослідження підтримають проведення клінічних випробувань пегозаферміну фази 3.
Хоча лікування пегозаферміном у дозі 44 мг раз на два тижні або 30 мг раз на тиждень досягло гістологічної первинної кінцевої точки дослідження, тривалість лікування в цьому дослідженні становила лише 24 тижні, а рівень дотримання режиму лікування в групі плацебо – лише 7%, що значно нижче, ніж результати попередніх клінічних досліджень тривалістю 48 тижнів. Чи однакові відмінності та безпека? Враховуючи гетерогенність НАЖХ, у майбутньому необхідні масштабніші, багатоцентрові міжнародні клінічні випробування, щоб охопити більші групи пацієнтів та продовжити тривалість лікування, щоб краще оцінити ефективність та безпеку препарату.
Час публікації: 16 вересня 2023 р.