Трансплантація легень є загальноприйнятим методом лікування запущених захворювань легень. За останні кілька десятиліть трансплантація легень досягла значного прогресу в скринінгу та оцінці стану реципієнтів трансплантатів, відборі, збереженні та розподілі донорських легень, хірургічних методиках, післяопераційному веденні, лікуванні ускладнень та імуносупресії.
За понад 60 років трансплантація легень пройшла шлях від експериментального лікування до загальноприйнятого стандартного методу лікування захворювань легень, що загрожують життю. Незважаючи на такі поширені проблеми, як первинна дисфункція трансплантата, хронічна дисфункція трансплантованих легень (ХДЛЛ), підвищений ризик опортуністичних інфекцій, рак та хронічні проблеми зі здоров'ям, пов'язані з імуносупресією, існує потенціал для покращення виживання пацієнтів та якості життя завдяки правильному вибору реципієнта. Хоча трансплантація легень стає все більш поширеною у світі, кількість операцій все ще не встигає за зростаючим попитом. Цей огляд зосереджений на поточному стані та останніх досягненнях у трансплантації легень, а також на майбутніх можливостях для ефективного впровадження цієї складної, але потенційно життєво важливої терапії.
Оцінка та відбір потенційних одержувачів
Оскільки легень від відповідних донорів відносно мало, трансплантаційні центри етично зобов'язані розподіляти донорські органи між потенційними реципієнтами, які мають найбільшу ймовірність отримати чисту користь від трансплантації. Традиційне визначення таких потенційних реципієнтів полягає в тому, що вони мають оціночний ризик смерті від захворювання легень протягом 2 років понад 50% та шанс вижити протягом 5 років після трансплантації понад 80%, за умови, що трансплантовані легені повністю функціональні. Найпоширенішими показаннями до трансплантації легень є легеневий фіброз, хронічне обструктивне захворювання легень, захворювання легеневих судин та муковісцидоз. Пацієнтів направляють на основі зниження функції легень, зниження фізичної функції та прогресування захворювання, незважаючи на максимальне використання медикаментів та хірургічного лікування; також враховуються інші критерії, специфічні для захворювання. Прогностичні проблеми підтримують стратегії раннього направлення, які дозволяють краще консультувати з урахуванням співвідношення ризиків та користі для покращення обґрунтованого спільного прийняття рішень та можливості змінити потенційні перешкоди для успішних результатів трансплантації. Багатопрофільна команда оцінить необхідність трансплантації легень та ризик пацієнта післятрансплантаційних ускладнень через застосування імуносупресантів, таких як ризик потенційно небезпечних для життя інфекцій. Скринінг на наявність дисфункції позалегеневих органів, фізичної підготовки, психічного здоров'я, системного імунітету та раку є критично важливим. Специфічні оцінки коронарних та церебральних артерій, функції нирок, здоров'я кісток, функції стравоходу, психосоціальної спроможності та соціальної підтримки є критично важливими, водночас вживаються заходи для забезпечення прозорості, щоб уникнути нерівності у визначенні придатності до трансплантації.
Множинні фактори ризику є більш шкідливими, ніж окремі фактори ризику. Традиційні перешкоди для трансплантації включають похилий вік, ожиріння, наявність раку в анамнезі, критичні захворювання та супутні системні захворювання, але ці фактори нещодавно були оскаржені. Вік реципієнтів неухильно зростає, і до 2021 року 34% реципієнтів у Сполучених Штатах будуть старшими за 65 років, що свідчить про все більший акцент на біологічному віці над хронологічним. Зараз, окрім шестихвилинної дистанції ходьби, часто проводиться більш формальна оцінка крихкості, зосереджуючись на фізичних резервах та очікуваних реакціях на стресові фактори. Крихкість пов'язана з поганими результатами після трансплантації легень, а крихкість зазвичай пов'язана зі складом тіла. Методи розрахунку ожиріння та складу тіла продовжують розвиватися, зосереджуючись менше на ІМТ і більше на вмісті жиру та м'язовій масі. Розробляються інструменти, які обіцяють кількісно визначити нестабільність, олігоміоз та стійкість, щоб краще прогнозувати здатність до відновлення після трансплантації легень. За допомогою передопераційної реабілітації легень можна змінити склад тіла та ослаблення, тим самим покращуючи результати.
У випадку гострого критичного захворювання визначення ступеня виснаження та здатності до одужання є особливо складним завданням. Трансплантації у пацієнтів, які отримують штучну вентиляцію легень, раніше були рідкістю, але зараз стають все більш поширеними. Крім того, використання екстракорпоральної підтримки життя як перехідного лікування перед трансплантацією зросло в останні роки. Досягнення в технологіях та судинному доступі дозволили свідомим, ретельно відібраним пацієнтам, які проходять екстракорпоральну підтримку життя, брати участь у процедурах інформованої згоди та фізичної реабілітації, а також досягати результатів після трансплантації, подібних до результатів пацієнтів, які не потребували екстракорпоральної підтримки життя до трансплантації.
Супутнє системне захворювання раніше вважалося абсолютним протипоказанням, але його вплив на результати після трансплантації тепер потребує спеціальної оцінки. Враховуючи, що імуносупресія, пов'язана з трансплантацією, збільшує ймовірність рецидиву раку, попередні рекомендації щодо вже існуючих злоякісних новоутворень наголошували на вимозі, щоб пацієнти не мали раку протягом п'яти років, перш ніж їх включатимуть до списку очікування на трансплантацію. Однак, оскільки методи лікування раку стають більш ефективними, зараз рекомендується оцінювати ймовірність рецидиву раку для кожного пацієнта індивідуально. Системне аутоімунне захворювання традиційно вважалося протипоказаним, і ця точка зору є проблематичною, оскільки запущені захворювання легень, як правило, обмежують тривалість життя таких пацієнтів. Нові рекомендації рекомендують, щоб трансплантації легень передувала більш цілеспрямована оцінка захворювання та лікування, щоб зменшити прояви захворювання, які можуть негативно вплинути на результати, такі як проблеми зі стравоходом, пов'язані зі склеродермією.
Циркулюючі антитіла проти певних підкласів HLA можуть зробити деяких потенційних реципієнтів алергічними до певних донорських органів, що призведе до збільшення часу очікування, зниження ймовірності трансплантації, гострого відторгнення органів та підвищеного ризику CLAD. Однак деякі трансплантації між антитілами кандидата-реципієнта та типами донорів досягли подібних результатів за допомогою передопераційних режимів десенсибілізації, включаючи плазмаферез, внутрішньовенний імуноглобулін та анти-В-клітинну терапію.
Вибір та застосування донорської легені
Донорство органів – це альтруїстичний акт. Отримання згоди донора та повага до його автономії є найважливішими етичними факторами. Легені донора можуть бути пошкоджені внаслідок травми грудної клітки, серцево-легеневої реанімації, аспірації, емболії, травми чи інфекції, пов’язаної з апаратом штучної вентиляції легень, або нейрогенного ураження, тому багато легень донора не підходять для трансплантації. ISHLT (Міжнародне товариство трансплантації серця та легень)
Трансплантація легень визначає загальноприйняті критерії донора, які варіюються від центру трансплантації до центру трансплантації. Фактично, дуже мало донорів відповідають «ідеальним» критеріям для донорства легень (Рисунок 2). Збільшення використання донорських легень було досягнуто завдяки послабленню критеріїв донора (тобто донори, які не відповідають загальноприйнятим ідеальним стандартам), ретельній оцінці, активному догляду за донорами та оцінці in vitro (Рисунок 2). Історія активного куріння донором є фактором ризику первинної дисфункції трансплантата у реципієнта, але ризик смерті від використання таких органів обмежений і його слід зважувати з урахуванням наслідків для смертності від тривалого очікування донорської легені від людини, яка ніколи не курила. Використання легень від старших (старших 70 років) донорів, які пройшли ретельний відбір і не мають інших факторів ризику, може досягти подібних результатів виживання реципієнта та функції легень, як і від молодших донорів.
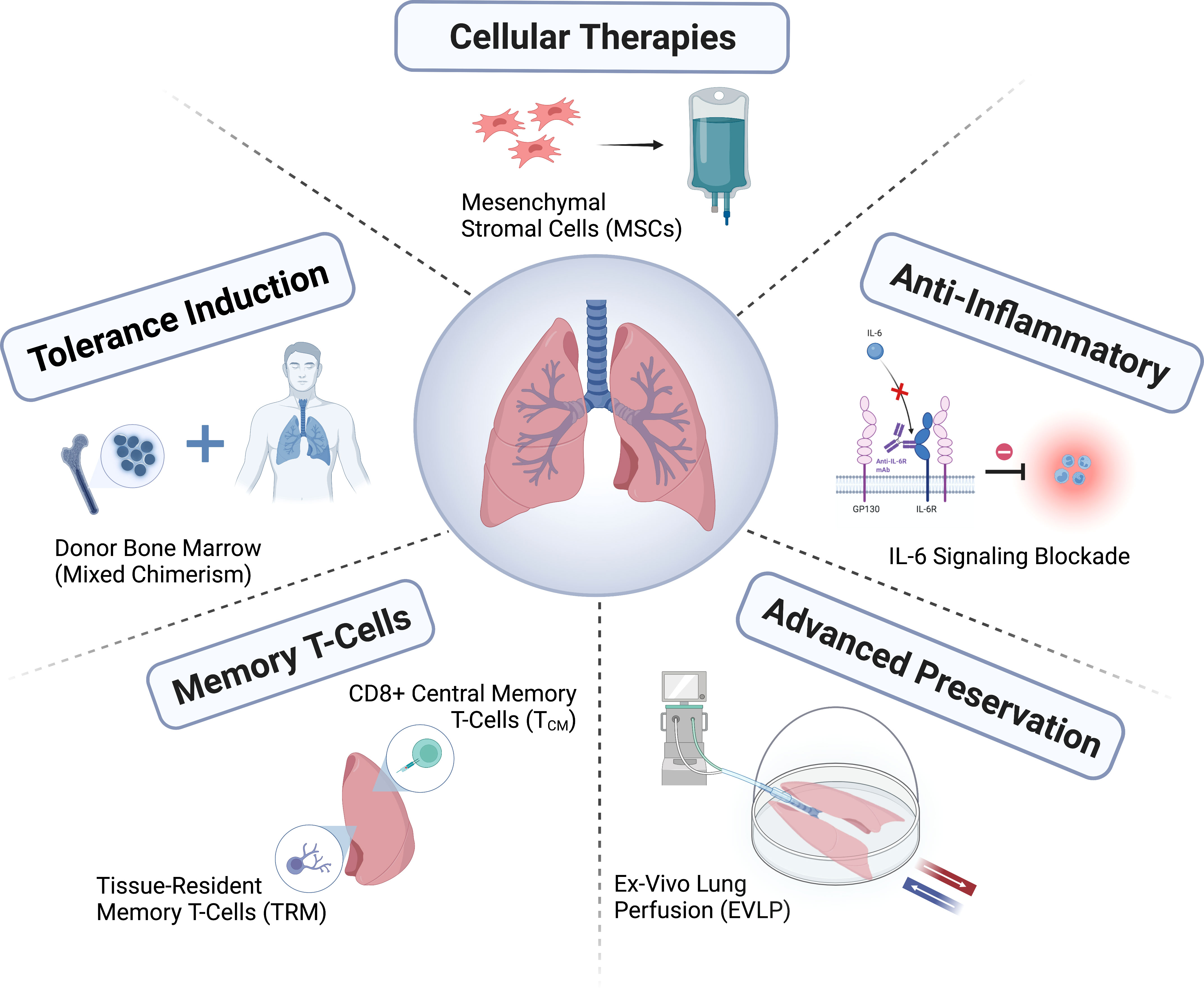
Належний догляд за донорами кількох органів та розгляд можливого донорства легень є важливими для забезпечення високої ймовірності придатності донорських легень для трансплантації. Хоча деякі з легень, що надаються наразі, відповідають традиційному визначенню ідеальної донорської легені, послаблення критеріїв, що виходять за рамки цих традиційних критеріїв, може призвести до успішного використання органів без шкоди для результатів. Стандартизовані методи консервації легень допомагають захистити цілісність органу перед його імплантацією реципієнту. Органи можуть бути транспортовані до трансплантаційних центрів за різних умов, таких як кріостатичне збереження або механічна перфузія при гіпотермії або нормальній температурі тіла. Легені, які не вважаються придатними для негайної трансплантації, можуть бути додатково об'єктивно оцінені та можуть бути оброблені перфузією легень in vitro (EVLP) або збережені протягом тривалішого часу, щоб подолати організаційні бар'єри для трансплантації. Тип трансплантації легень, процедура та інтраопераційна підтримка залежать від потреб пацієнта та досвіду та уподобань хірурга. Для потенційних реципієнтів трансплантації легень, у яких захворювання різко погіршується під час очікування трансплантації, екстракорпоральна підтримка життя може розглядатися як перехідний метод лікування перед трансплантацією. Ранні післяопераційні ускладнення можуть включати кровотечу, обструкцію дихальних шляхів або судинного анастомозу та інфекцію рани. Пошкодження діафрагмального або блукаючого нерва в грудній клітці може призвести до інших ускладнень, що впливають на функцію діафрагми та спорожнення шлунка відповідно. Донорська легеня може мати раннє гостре ураження легень після імплантації та реперфузії, тобто первинну дисфункцію трансплантата. Має сенс класифікувати та лікувати тяжкість первинної дисфункції трансплантата, яка пов'язана з високим ризиком ранньої смерті. Оскільки потенційне пошкодження донорської легені відбувається протягом кількох годин після початкового ураження мозку, лікування легень повинно включати належне налаштування вентиляції легень, альвеолярне розправлення, бронхоскопію та аспірацію та промивання (для відбору проб культур), управління рідиною пацієнта та корекцію положення грудної клітки. ABO означає групу крові A, B, AB та O, CVP означає центральний венозний тиск, DCD означає смерть донора легень від серцевої смерті, ECMO означає екстракорпоральну мембранну оксигенацію, EVLW означає екстраваскулярну легеневу воду, PaO2/FiO2 означає співвідношення парціального тиску кисню в артеріальній артерії до концентрації кисню, що вдихається, а PEEP означає позитивний тиск наприкінці видиху. PiCCO являє собою серцевий викид хвилі пульсового індексу.
У деяких країнах використання контрольованої донорської легені (КДЛ) зросло до 30-40% у пацієнтів зі смертю від серцевого нападу, і були досягнуті аналогічні показники гострого відторгнення органів, КДЛ та виживання. Традиційно органів від донорів, інфікованих інфекційним вірусом, слід уникати для трансплантації неінфікованим реципієнтам; однак, в останні роки противірусні препарати, що діють безпосередньо проти вірусу гепатиту С (ВГС), дозволили безпечно трансплантувати ВГС-позитивні донорські легені ВГС-негативним реципієнтам. Аналогічно, легені донорів, інфікованих вірусом імунодефіциту людини (ВІЛ), можна трансплантувати ВІЛ-позитивним реципієнтам, а легені донорів, інфікованих вірусом гепатиту В (ВГВ), можна трансплантувати реципієнтам, які були вакциновані проти ВГВ, та тим, хто має імунітет. Були повідомлення про трансплантацію легень від активних або раніше інфікованих SARS-CoV-2 донорів. Нам потрібно більше доказів, щоб визначити безпеку інфікування донорських легень інфекційними вірусами для трансплантації.
Через складність отримання кількох органів оцінити якість донорських легень є складним завданням. Використання системи перфузії легень in vitro для оцінки дозволяє детальніше оцінити функцію донорських легень та потенціал для її відновлення перед використанням (Рисунок 2). Оскільки донорська легеня дуже схильна до пошкоджень, система перфузії легень in vitro забезпечує платформу для застосування специфічних біологічних методів лікування для відновлення пошкодженої донорської легені (Рисунок 2). Два рандомізовані дослідження показали, що перфузія легень донорів in vitro при нормальній температурі тіла, яка відповідає загальноприйнятим критеріям, є безпечною, і що команда трансплантологів може таким чином продовжити час зберігання. Повідомлялося, що збереження донорських легень при вищій гіпотермії (від 6 до 10°C), а не при 0-4°C на льоду, покращує здоров'я мітохондрій, зменшує пошкодження та покращує функцію легень. Для напівселективних денних трансплантацій повідомлялося, що триваліше збереження протягом ночі досягає хороших результатів після трансплантації. Наразі проводиться велике не менш ефективне дослідження безпеки, яке порівнює збереження при 10°C зі стандартною кріоконсервацією (реєстраційний номер NCT05898776 на ClinicalTrials.gov). Люди дедалі частіше пропагують своєчасне відновлення органів через центри догляду за донорами багатьох органів та покращення функції органів через центри відновлення органів, щоб органи кращої якості можна було використовувати для трансплантації. Вплив цих змін на екосистему трансплантації все ще оцінюється.
Для збереження контрольованих органів DCD, локальна перфузія нормальної температури тіла in situ за допомогою екстракорпоральної мембранної оксигенації (ЕКМО) може бути використана для оцінки функції органів черевної порожнини та підтримки прямого отримання та збереження органів грудної клітки, включаючи легені. Досвід трансплантації легень після локальної перфузії нормальної температури тіла в грудній клітці та черевній порожнині обмежений, а результати неоднозначні. Існують побоювання, що ця процедура може завдати шкоди померлим донорам та порушити основні етичні принципи вилучення органів; Тому локальна перфузія при нормальній температурі тіла ще не дозволена в багатьох країнах.
Рак
Захворюваність на рак у популяції після трансплантації легень вища, ніж у загальній популяції, а прогноз, як правило, несприятливий, що становить 17% смертей. Рак легень та посттрансплантаційне лімфопроліферативне захворювання (ПТЛЗ) є найпоширенішими причинами смерті, пов'язаної з раком. Тривала імуносупресія, наслідки попереднього куріння або ризик основного захворювання легень призводять до ризику розвитку раку легень у власній легені реципієнта однієї легені, але в рідкісних випадках субклінічний рак легень, переданий від донора, також може виникати в трансплантованих легенях. Немеланомний рак шкіри є найпоширенішим видом раку серед реципієнтів трансплантатів, тому регулярний моніторинг раку шкіри є важливим. В-клітинне ПТЛЗ, спричинене вірусом Епштейна-Барр, є важливою причиною захворювання та смерті. Хоча ПТЛЗ може вилікуватися з мінімальною імуносупресією, зазвичай потрібна таргетна терапія В-клітин ритуксимабом, системна хіміотерапія або обидва методи.
Виживання та довгострокові результати
Виживання після трансплантації легень залишається обмеженим порівняно з іншими видами трансплантації органів, з медіаною 6,7 років, і протягом трьох десятиліть досягнуто незначного прогресу в довгострокових результатах лікування пацієнтів. Однак багато пацієнтів відчули значне покращення якості життя, фізичного стану та інших результатів, про які повідомляли пацієнти; для проведення більш комплексної оцінки терапевтичного ефекту трансплантації легень необхідно приділяти більше уваги результатам, про які повідомляли ці пацієнти. Важливою незадоволеною клінічною потребою є вирішення питання смерті реципієнта від фатальних ускладнень, пов'язаних із затримкою відторгнення трансплантата або тривалою імуносупресією. Реципієнтам трансплантатів легень слід надавати активний довгостроковий догляд, що вимагає командної роботи для захисту загального здоров'я реципієнта шляхом моніторингу та підтримки функції трансплантата, з одного боку, мінімізації несприятливих наслідків імуносупресії та підтримки фізичного та психічного здоров'я реципієнта, з іншого боку (Рисунок 1).
Майбутній напрямок
Трансплантація легень – це метод лікування, який пройшов довгий шлях за короткий час, але ще не досяг свого повного потенціалу. Нестача відповідних донорських легень залишається серйозною проблемою, і нові методи оцінки та догляду за донорами, лікування та відновлення донорських легень, а також покращення збереження донорів все ще розробляються. Необхідно вдосконалити політику розподілу органів шляхом покращення підбору донорів та реципієнтів для подальшого збільшення чистої вигоди. Зростає інтерес до діагностики відторгнення або інфекції за допомогою молекулярної діагностики, зокрема за допомогою вільної ДНК, отриманої від донора, або до мінімізації імуносупресії; Однак корисність цієї діагностики як доповнення до сучасних методів клінічного моніторингу трансплантата ще належить визначити.
Галузь трансплантації легень розвивалася завдяки формуванню консорціумів (наприклад, реєстраційний номер ClinicalTrials.gov NCT04787822; https://lungtransplantconsortium.org) для спільної роботи, що допоможе у профілактиці та лікуванні первинної дисфункції трансплантата, прогнозуванні CLAD, ранній діагностиці та визначенні внутрішніх точок (ендотипування), синдромі уточнення. Швидший прогрес був досягнутий у вивченні первинної дисфункції трансплантата, антитілоопосередкованого відторгнення, механізмів ALAD та CLAD. Мінімізація побічних ефектів та зниження ризику ALAD та CLAD за допомогою персоналізованої імуносупресивної терапії, а також визначення орієнтованих на пацієнта результатів та їх включення до показників результатів, будуть ключовими для покращення довгострокового успіху трансплантації легень.
Час публікації: 23 листопада 2024 р.