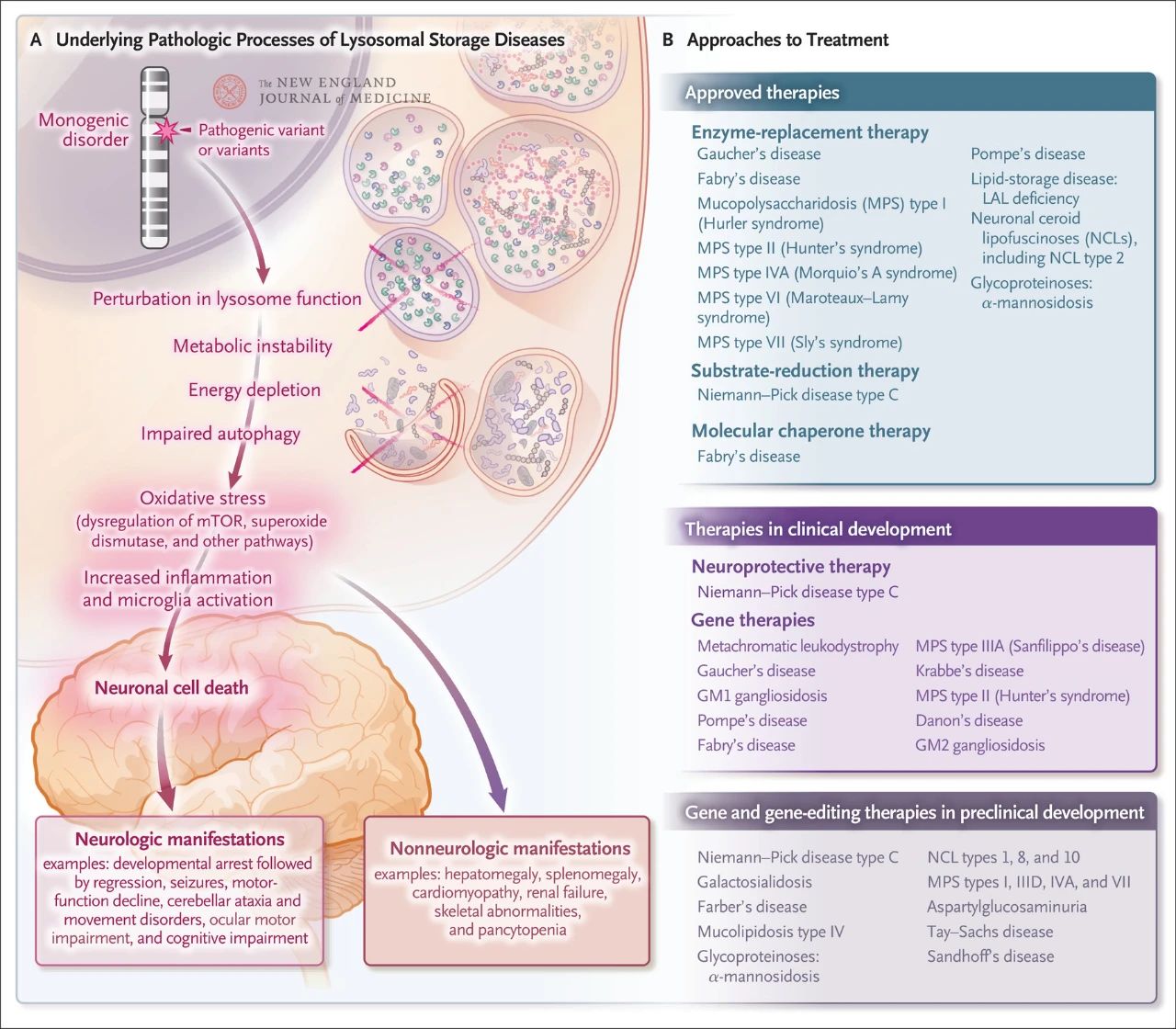
Хоча це відносно рідкісне явище, загальна частота лізосомного накопичення становить приблизно 1 на кожні 5000 живонароджених. Крім того, з майже 70 відомих лізосомних порушень накопичення 70% вражають центральну нервову систему. Ці моногенні порушення викликають лізосомну дисфункцію, що призводить до метаболічної нестабільності, порушення регуляції цільового білка рапаміцину у ссавців (mTOR, який зазвичай пригнічує запалення), порушення аутофагії та загибелі нервових клітин. Кілька методів лікування, спрямованих на основні патологічні механізми лізосомного накопичення, були схвалені або розробляються, включаючи ферментозамісну терапію, терапію зменшення субстрату, молекулярну шаперонну терапію, генну терапію, редагування генів та нейропротекторну терапію.
Хвороба Німана-Піка типу C – це порушення клітинного транспорту холестерину в лізосомах, спричинене біалельними мутаціями в NPC1 (95%) або NPC2 (5%). Симптоми хвороби Німана-Піка типу C включають швидке, смертельне неврологічне зниження у немовлячому віці, тоді як пізні ювенільні, ювенільні та дорослі форми включають спленомегалію, надядерний параліч погляду та мозочкову атаксію, дизартикуляцію та прогресуючу деменцію.
У цьому випуску журналу Бремова-Ертль та ін. повідомляють про результати подвійного сліпого, плацебо-контрольованого, перехресного дослідження. У дослідженні для лікування хвороби Німана-Піка типу С використовувався потенційний нейропротекторний засіб, аналог амінокислоти N-ацетил-L-лейцин (NALL). До дослідження було залучено 60 симптоматичних пацієнтів підліткового та дорослого віку, і результати показали значне покращення загального балу (первинної кінцевої точки) за шкалою оцінки та рейтингу атаксії.
Клінічні випробування N-ацетил-DL-лейцину (Танганілу), рацемічної сполуки NALL та n-ацетил-D-лейцину, здається, значною мірою зумовлені досвідом: механізм дії досі не був чітко з'ясований. N-ацетил-DL-лейцин був схвалений для лікування гострого запаморочення з 1950-х років; моделі на тваринах показують, що препарат діє шляхом відновлення балансу надмірної поляризації та деполяризації медіальних вестибулярних нейронів. Згодом Страпп та ін. повідомили про результати короткострокового дослідження, в якому вони спостерігали покращення симптомів у 13 пацієнтів з дегенеративною мозочковою атаксією різної етіології, що знову викликало інтерес до повторного вивчення цього препарату.
Механізм, за допомогою якого n-ацетил-DL-лейцин покращує функцію нервів, ще не з'ясований, але результати досліджень на двох моделях мишей: одній з хворобою Німана-Піка типу C та іншій з синдромом накопичення гангліозидів GM2 варіанта O (хвороба Сандхоффа), ще одним нейродегенеративним лізосомним захворюванням, спонукали звернути увагу на NALL. Зокрема, виживання мишей Npc1-/-, яких отримували n-ацетил-DL-лейцин або NALL (L-енантіомери), покращилося, тоді як виживання мишей, яких отримували n-ацетил-D-лейцин (D-енантіомери), – ні, що свідчить про те, що NALL є активною формою препарату. У аналогічному дослідженні синдрому накопичення гангліозидів GM2 варіанта O (Hexb-/-) n-ацетил-DL-лейцин призвів до незначного, але значного продовження тривалості життя мишей.
Щоб дослідити механізм дії n-ацетил-DL-лейцину, дослідники досліджували метаболічний шлях лейцину, вимірюючи метаболіти в тканинах мозочка мутантних тварин. У варіанті O моделі порушення накопичення гангліозидів GM2 n-ацетил-DL-лейцин нормалізує метаболізм глюкози та глутамату, посилює аутофагію та підвищує рівень супероксиддисмутази (активного поглинача кисню). У C-моделі хвороби Німана-Піка спостерігалися зміни в метаболізмі глюкози та антиоксидантів, а також покращення енергетичного обміну мітохондрій. Хоча L-лейцин є потужним активатором mTOR, не спостерігалося жодних змін у рівні або фосфорилюванні mTOR після лікування n-ацетил-DL-лейцином або його енантіомерами в жодній з моделей мишей.
Нейропротекторний ефект NALL спостерігався на мишачій моделі пошкодження мозку, викликаного кортикальним зіткненням. Ці ефекти включають зниження нейрозапальних маркерів, зменшення загибелі клітин кори та покращення потоку аутофагії. Після лікування NALL рухові та когнітивні функції пошкоджених мишей відновлювалися, а розмір ураження зменшувався.
Запальна реакція центральної нервової системи є ознакою більшості нейродегенеративних лізосомних захворювань накопичення. Якщо нейрозапалення можна зменшити за допомогою лікування NALL, клінічні симптоми багатьох, якщо не всіх, нейродегенеративних лізосомних захворювань накопичення можуть бути покращені. Як показує це дослідження, очікується, що NALL також матиме синергію з іншими методами лікування лізосомних захворювань накопичення.
Багато лізосомних порушень накопичення також пов'язані з мозочковою атаксією. Згідно з міжнародним дослідженням, в якому брали участь діти та дорослі з порушеннями накопичення гангліозидів GM2 (хвороба Тея-Сакса та хвороба Сандхоффа), атаксія зменшилася, а координація дрібних моторних рухів покращилася після лікування NALL. Однак велике, багатоцентрове, подвійне сліпе, рандомізоване, плацебо-контрольоване дослідження показало, що n-ацетил-DL-лейцин не був клінічно ефективним у пацієнтів зі змішаною (спадковою, неспадковою та нез'ясованою) мозочковою атаксією. Цей висновок свідчить про те, що ефективність може спостерігатися лише в дослідженнях, в яких брали участь пацієнти зі спадковою мозочковою атаксією та проаналізовані пов'язані з нею механізми дії. Крім того, оскільки NALL зменшує нейрозапалення, яке може призвести до черепно-мозкової травми, можна розглянути дослідження NALL для лікування черепно-мозкової травми.
Час публікації: 02 березня 2024 р.