Кахексія – це системне захворювання, що характеризується втратою ваги, атрофією м’язової та жирової тканини, а також системним запаленням. Кахексія є одним з основних ускладнень та причин смерті у онкологічних хворих. Окрім раку, кахексія може бути спричинена різноманітними хронічними незлоякісними захворюваннями, включаючи серцеву недостатність, ниркову недостатність, хронічне обструктивне захворювання легень, неврологічні захворювання, СНІД та ревматоїдний артрит. За оцінками, частота кахексії у онкологічних хворих може сягати від 25% до 70%, що серйозно впливає на якість життя пацієнтів та посилює токсичність, пов’язану з лікуванням.
Ефективне втручання при кахексії має велике значення для покращення якості життя та прогнозу онкологічних хворих. Однак, незважаючи на певний прогрес у вивченні патофізіологічних механізмів кахексії, багато препаратів, розроблених на основі можливих механізмів, є лише частково ефективними або неефективними. Наразі не існує ефективного лікування, схваленого Управлінням з контролю за продуктами харчування та лікарськими засобами США (FDA).
Існує багато причин невдачі клінічних випробувань кахексії, і фундаментальна причина може полягати у відсутності глибокого розуміння механізму та природного перебігу кахексії. Нещодавно професор Сяо Руйпін та дослідник Ху Сіньлі з Коледжу майбутніх технологій Пекінського університету спільно опублікували статтю в Nature Metabolism, розкриваючи важливу роль шляху лактат-GPR81 у виникненні ракової кахексії, пропонуючи нову ідею для лікування кахексії. Ми підсумовуємо це, синтезуючи статті з Nat Metab, Science, Nat Rev Clin Oncol та інших журналів.
Втрата ваги зазвичай спричинена зменшенням споживання їжі та/або збільшенням витрат енергії. Попередні дослідження показали, що ці фізіологічні зміни в кахексії, пов'язаній з пухлиною, зумовлені певними цитокінами, що секретуються мікрооточенням пухлини. Наприклад, такі фактори, як фактор диференціації росту 15 (GDF15), ліпокалін-2 та інсуліноподібний білок 3 (INSL3), можуть пригнічувати споживання їжі, зв'язуючись з регуляторними ділянками апетиту в центральній нервовій системі, що призводить до анорексії у пацієнтів. IL-6, PTHrP, активін А та інші фактори сприяють втраті ваги та атрофії тканин, активуючи катаболічний шлях та збільшуючи витрати енергії. Наразі дослідження механізму кахексії в основному зосереджені на цих секретованих білках, і мало досліджень стосувалися зв'язку між метаболітами пухлини та кахексією. Професор Сяо Руйпін та дослідник Ху Сіньлі застосували новий підхід, щоб розкрити важливий механізм кахексії, пов'язаної з пухлиною, з точки зору метаболітів пухлини.
Спочатку команда професора Сяо Руйпіна дослідила тисячі метаболітів у крові здорових контрольних осіб та мишей на моделі кахексії раку легенів і виявила, що молочна кислота була найбільш суттєво підвищеним метаболітом у мишей з кахексією. Рівень молочної кислоти в сироватці крові збільшувався зі зростанням пухлини та демонстрував сильну кореляцію зі зміною ваги мишей з пухлиною. Зразки сироватки, зібрані у пацієнтів з раком легенів, підтверджують, що молочна кислота також відіграє ключову роль у прогресуванні кахексії раку людини.
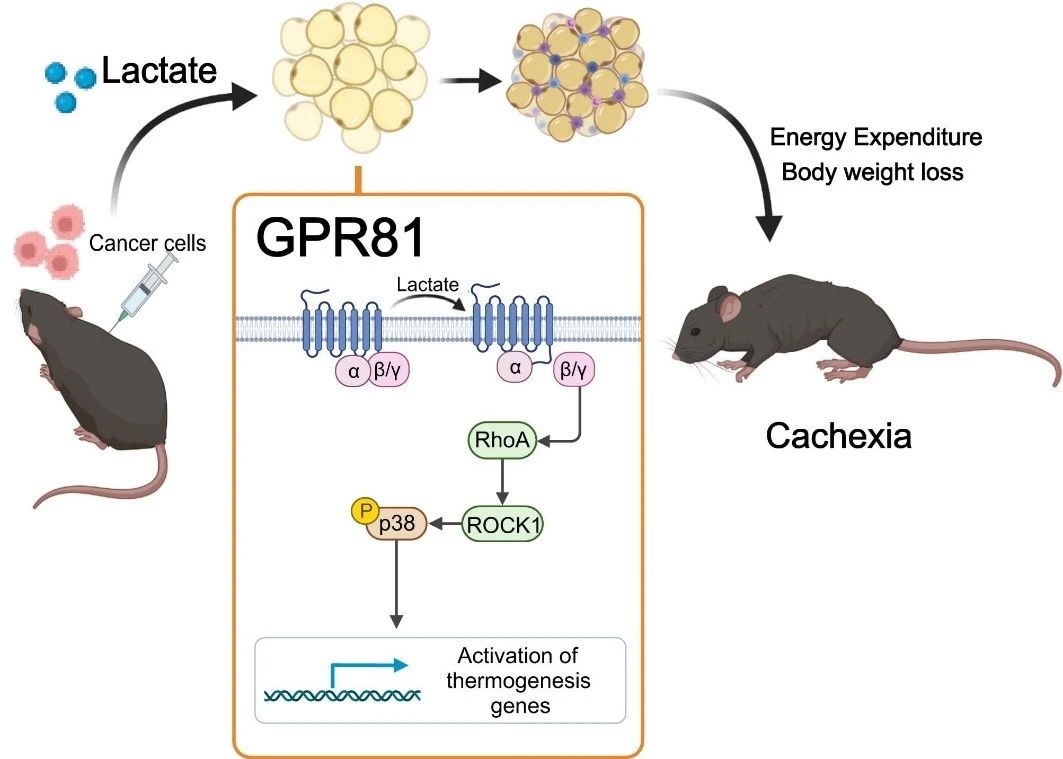
Щоб визначити, чи викликає високий рівень молочної кислоти кахексію, дослідницька група доставляла молочну кислоту в кров здорових мишей за допомогою осмотичного насоса, імплантованого під шкіру, штучно підвищуючи рівень молочної кислоти в сироватці крові до рівня мишей з кахексією. Через 2 тижні у мишей розвинувся типовий фенотип кахексії, такий як втрата ваги, атрофія жирової та м'язової тканин. Ці результати свідчать про те, що індуковане лактатом ремоделювання жиру подібне до того, що індуковане раковими клітинами. Лактат є не тільки характерним метаболітом ракової кахексії, але й ключовим медіатором гіперкатаболічного фенотипу, індукованого раком.
Далі вони виявили, що делеція лактатного рецептора GPR81 була ефективною у полегшенні проявів кахексії, викликаної пухлиною та сироватковим лактатом, без впливу на рівень лактату в сироватці крові. Оскільки GPR81 високо експресується в жировій тканині та змінюється в жировій тканині раніше, ніж у скелетних м'язах під час розвитку кахексії, специфічний нокаутний ефект GPR81 у жировій тканині миші подібний до системного нокауту, покращуючи втрату ваги, викликану пухлиною, та споживання жиру та скелетних м'язів. Це свідчить про те, що GPR81 у жировій тканині необхідний для розвитку ракової кахексії, спричиненої молочною кислотою.
Подальші дослідження підтвердили, що після зв'язування з GPR81, молекули молочної кислоти викликають жирове побуріння, ліполіз та збільшення системного вироблення тепла через сигнальний шлях Gβγ-RhoA/ROCK1-p38, а не класичний шлях PKA.
Незважаючи на багатообіцяючі результати в патогенезі кахексії, пов'язаної з раком, ці висновки ще не знайшли застосування в ефективних методах лікування, тому наразі немає стандартів лікування для цих пацієнтів, але деякі товариства, такі як ESMO та Європейське товариство клінічного харчування та метаболізму, розробили клінічні рекомендації. Наразі міжнародні рекомендації наполегливо рекомендують стимулювати метаболізм та зменшувати катаболізм за допомогою таких підходів, як харчування, фізичні вправи та медикаменти.
Час публікації: 28 квітня 2024 р.