Нозокоміальна пневмонія є найпоширенішою та найсерйознішою нозокоміальною інфекцією, 40% якої припадає на вентилятор-асоційовану пневмонію (ВАП). ВАП, спричинена резистентними патогенами, все ще є складною клінічною проблемою. Протягом багатьох років рекомендації рекомендували низку втручань (таких як цілеспрямована седація, підняття голови) для запобігання ВАП, але ВАП зустрічається у 40% пацієнтів з інтубацією трахеї, що призводить до тривалішого перебування в лікарні, збільшення використання антибіотиків та смерті. Люди завжди шукають ефективніші профілактичні заходи.
Вентиляторно-асоційована пневмонія (ВАП) – це новий тип пневмонії, що розвивається через 48 годин після інтубації трахеї та є найпоширенішою та найсмертельнішою внутрішньолікарняною інфекцією у відділенні інтенсивної терапії (ВІТ). У рекомендаціях Американського товариства інфекційних захворювань 2016 року ВАП відрізняється від визначення внутрішньолікарняної пневмонії (ВЛП) (ВАП стосується лише пневмонії, яка виникає після госпіталізації без трахеальної трубки та не пов’язана зі штучною вентиляцією легень; ВАП – це пневмонія після інтубації трахеї та штучної вентиляції легень), а Європейське товариство та Китай вважають, що ВАП все ще є особливим типом ВЛП [1-3].
У пацієнтів, які отримують штучну вентиляцію легень, частота виникнення вентиляційно-профілактичної інфекції (ВАП) коливається від 9% до 27%, рівень смертності оцінюється в 13%, і це може призвести до збільшення системного застосування антибіотиків, тривалої штучної вентиляції легень, тривалого перебування у відділенні інтенсивної терапії та збільшення витрат [4-6]. ВПЛ/ВАП у пацієнтів без імунодефіциту зазвичай спричинена бактеріальною інфекцією, а розподіл поширених патогенів та їх характеристики резистентності варіюються залежно від регіону, класу лікарні, популяції пацієнтів та впливу антибіотиків, а також змінюються з часом. Pseudomonas aeruginosa домінувала серед патогенів, пов'язаних з ВАП, у Європі та Америці, тоді як у третинних лікарнях Китаю було виділено більше Acinetobacter baumannii. Від третини до половини всіх смертей, пов'язаних з ВАП, безпосередньо спричинені інфекцією, причому рівень смертності у випадках, спричинених Pseudomonas aeruginosa та Acinetobacter, є вищим [7,8].
Через сильну гетерогенність вентиляційно-аурикульозної пневмонії (ВАП), діагностична специфічність її клінічних проявів, візуалізаційних та лабораторних тестів є низькою, а діапазон диференціальної діагностики широкий, що ускладнює своєчасну діагностику ВАП. Водночас, бактеріальна резистентність створює серйозну проблему для лікування ВАП. За оцінками, ризик розвитку ВАП становить 3%/день протягом перших 5 днів використання штучної вентиляції легень, 2%/день між 5 та 10 днями та 1%/день протягом решти часу. Пік захворюваності зазвичай припадає на 7 днів вентиляції, тому існує вікно, в якому інфекції можна запобігти на ранній стадії [9,10]. Багато досліджень розглядали профілактику ВАП, але, незважаючи на десятиліття досліджень та спроб запобігти ВАП (таких як уникнення інтубації, запобігання повторній інтубації, зменшення седації, підняття узголів'я ліжка на 30°-45° та догляд за ротовою порожниною), захворюваність, здається, не зменшилася, а пов'язаний з цим медичний тягар залишається дуже високим.
Інгаляційні антибіотики використовуються для лікування хронічних інфекцій дихальних шляхів з 1940-х років. Оскільки вони можуть максимізувати доставку ліків до цільового місця інфекції (тобто дихальних шляхів) та зменшити системні побічні ефекти, вони продемонстрували хорошу цінність застосування при різних захворюваннях. Інгаляційні антибіотики зараз схвалені Управлінням з контролю за продуктами харчування та лікарськими засобами США (FDA) та Європейським агентством з лікарських засобів (EMA) для використання при муковісцидозі. Інгаляційні антибіотики можуть значно зменшити бактеріальне навантаження та частоту загострень при бронхоектазах без збільшення загальної кількості побічних ефектів, і чинні рекомендації визнають їх препаратами першої лінії для пацієнтів з інфекцією Pseudomonas aeruginosa та частими загостреннями; Інгаляційні антибіотики в періопераційному періоді трансплантації легень також можуть використовуватися як допоміжні або профілактичні препарати [11,12]. Але в рекомендаціях США щодо VAP 2016 року експерти не висловили впевненості в ефективності допоміжних інгаляційних антибіотиків через відсутність великих рандомізованих контрольованих досліджень. Дослідження фази 3 (INHALE), опубліковане у 2020 році, також не отримало позитивних результатів (інгаляція амікацину з внутрішньовенним введенням антибіотиків при грамнегативних бактеріальних інфекціях, спричинених пацієнтами з вентилятор-аптекою, подвійне сліпе, рандомізоване, плацебо-контрольоване дослідження ефективності фази 3, загалом 807 пацієнтів, системні препарати + інгаляція амікацину протягом 10 днів).
У цьому контексті команда дослідників з Регіонального університетського лікарняного центру Тура (CHRU) у Франції обрала іншу дослідницьку стратегію та провела ініційоване дослідником багатоцентрове подвійне сліпе рандомізоване контрольоване дослідження ефективності (AMIKINHAL). Інгаляційний амікацин або плацебо для профілактики вентилятор-асоційованої пневмонії (ВАП) порівнювали у 19 відділеннях інтенсивної терапії у Франції [13].
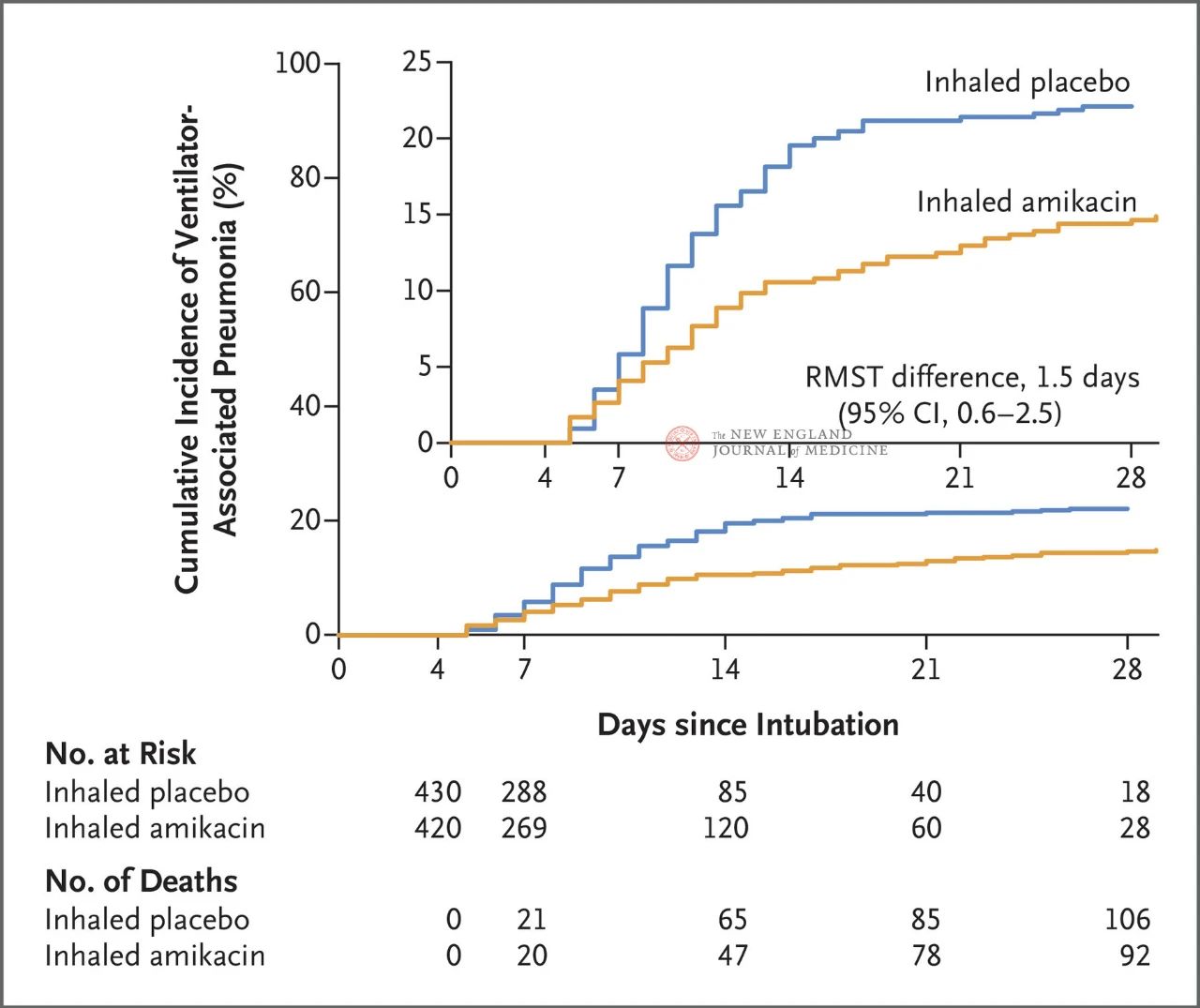
Загалом 847 дорослих пацієнтів з інвазивною штучною вентиляцією легень тривалістю від 72 до 96 годин були випадковим чином розподілені у співвідношенні 1:1 на інгаляції амікацину (N = 417,20 мг/кг ідеальної маси тіла, 1 день) або інгаляції плацебо (N = 430, 0,9% еквівалент хлориду натрію) протягом 3 днів. Первинною кінцевою точкою був перший епізод вентиляції легень (ВАП) від початку рандомізованого розподілу до 28-го дня.
Результати дослідження показали, що через 28 днів у 62 пацієнтів (15%) у групі амікацину розвинулася вентиляційно-аурикулятивна інфекція (ВАП), а у 95 пацієнтів (22%) у групі плацебо – ВАП (обмежена середня різниця виживання для ВАП становила 1,5 дня; 95% ДІ, 0,6~2,5; P = 0,004).
Що стосується безпеки, у семи пацієнтів (1,7%) у групі амікацину та у чотирьох пацієнтів (0,9%) у групі плацебо виникли серйозні побічні ефекти, пов'язані з дослідженням. Серед тих, у кого не було гострого ураження нирок на момент рандомізації, у 11 пацієнтів (4%) у групі амікацину та у 24 пацієнтів (8%) у групі плацебо гостре ураження нирок виникло на 28-й день (ВР 0,47; 95% ДІ 0,23~0,96).
Клінічне випробування мало три основні моменти. По-перше, з точки зору дизайну дослідження, дослідження AMIKINHAL спирається на дослідження IASIS (рандомізоване, подвійне сліпе, плацебо-контрольоване, паралельне дослідження фази 2 за участю 143 пацієнтів). Для оцінки безпеки та ефективності інгаляцій амікацину-фосфоміцину для системного лікування грамнегативних бактеріальних інфекцій, спричинених вентилятором (ВАП), та дослідження INHALE, яке завершилося негативними результатами, було винесено висновки, що зосереджені на профілактиці ВАП, та отримані відносно хороші результати. Через особливості високої смертності та тривалого перебування в лікарні у пацієнтів на штучній вентиляції легень та ВАП, якщо інгаляції амікацину можуть досягти суттєво різних результатів у зменшенні смертності та перебування в лікарні у цих пацієнтів, це буде більш цінним для клінічної практики. Однак, враховуючи неоднорідність пізнього лікування та догляду у кожного пацієнта та кожного центру, існує низка факторів, що впливають на результат дослідження, тому також може бути важко отримати позитивний результат, пов'язаний з інгаляційними антибіотиками. Тому успішне клінічне дослідження вимагає не лише відмінного дизайну дослідження, але й вибору відповідних первинних кінцевих точок.
По-друге, хоча аміноглікозидні антибіотики не рекомендуються як окремий препарат у різних рекомендаціях щодо вентиляційної апное (ВАП), аміноглікозидні антибіотики можуть охоплювати поширені збудники у пацієнтів з ВАП (включаючи синьогнійну паличку, ацинетобактер тощо), і завдяки їх обмеженому всмоктуванню в епітеліальні клітини легень, високій концентрації в місці інфекції та низькій системній токсичності. Аміноглікозидні антибіотики широко переважають серед інгаляційних антибіотиків. Ця стаття узгоджується з комплексною оцінкою розміру ефекту інтратрахеального введення гентаміцину в невеликих вибірках, опублікованою раніше, яка спільно демонструє вплив інгаляційних аміноглікозидних антибіотиків на запобігання ВАП. Слід також зазначити, що більшість плацебо-контролів, відібраних у дослідженнях, пов'язаних з інгаляційними антибіотиками, є фізіологічним розчином. Однак, враховуючи, що розпилене вдихання фізіологічного розчину саме по собі може відігравати певну роль у розрідженні мокротиння та допомагати відхаркувальній дії, фізіологічний розчин може спричинити певні перешкоди в аналізі результатів дослідження, що слід всебічно враховувати в дослідженні.
Крім того, важлива локальна адаптація препаратів HAP/VAP, як і антибіотикопрофілактика. Водночас, незалежно від тривалості інтубації, екологія місцевого відділення інтенсивної терапії є найважливішим фактором ризику інфікування бактеріями, стійкими до множинних ліків. Тому емпіричне лікування повинно максимально ґрунтуватися на мікробіологічних даних місцевих лікарень і не може сліпо посилатися на рекомендації чи досвід лікарень третинного рівня. Водночас, критично хворі пацієнти, які потребують штучної вентиляції легень, часто мають поєднані захворювання різних систем, і під спільною дією кількох факторів, таких як стресовий стан, може також спостерігатися явище перехресного впливу кишкових мікробів на легені. Висока гетерогенність захворювань, спричинена внутрішньою та зовнішньою суперпозицією, також визначає, що масштабне клінічне просування кожного нового втручання є ще довгим шляхом.
Час публікації: 02 грудня 2023 р.